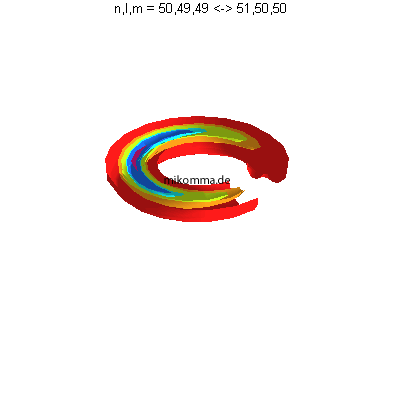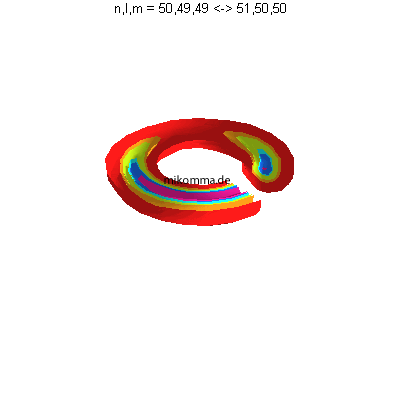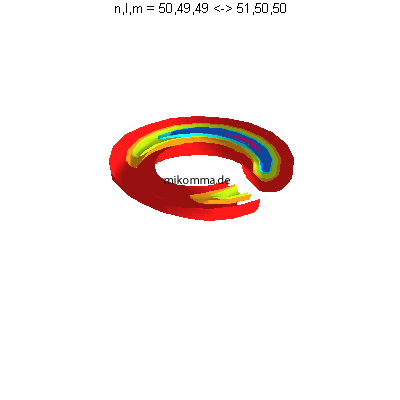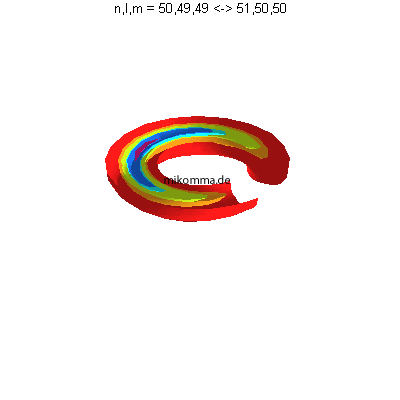|
Die Formel für die Wasserstoffwellenfunktionen lautet:


In den folgenden Darstellungen wird die mit r
multiplizierte Wahrscheinlichkeitsdichte verwendet. In dem Zeitfaktor ist das
Wirkungsquantum h gleich 1 gesetzt und die Längeneinheit ist der
Bohrsche Radius a
0. (In Realexperimenten verwendet man nicht Wasserstoff,
sondern z.B. Rubidium. Dann muss noch die Kernladungszahl berücksichtigt
werden.)
Für kreisförmige Rydbergatome ist l = m = n-1,
wodurch die Formel drastisch vereinfacht wird:

Dabei ist N ein von
den Quantenzahlen abhängiger Normierungsfaktor
und R die Radialfunktion (die von r
abhängigen Faktoren in der allgemeinen Formel
ohne den Faktor r am Ende). Von den Legendrepolynomen P bleibt nur eine
Potenz (l) des Sinus vom Polarwinkel
übrig, d.h., das Elektron ist für große l
"praktisch" nur in der "Äquatorebene" des Atoms
anzutreffen.
Für l = n-1 bleibt vom
Laguerrepolynom L nur eine Konstante übrig und
die Radialfunktion hat nur ein Maximum (und keine
Nullstellen). Nebenstehend sind die mit
r multiplizierten Radialfunktionen
abgebildet, und zwar für die Quantenzahlen n =
50
(rot) und n = 51
(blau). Zum Vergleich die Radialfunktionen für
n
= 10 und 20 (schwarz). Für r ist auf der
Abszisse n2, also die
Vielfachen von a
0 abgetragen.
Man sieht: für große Quantenzahlen hält sich das
Elektron nicht an die von Bohr ausschließlich
erlaubten Bahnen, sondern vagabundiert lustig
über alle möglichen "stationären Zustände"
(etwa von n= 42 bis n=60) und
verbotene Zonen (und zwar kontinuierlich!), so
dass es vom 2000-fachen bis zum 4000-fachen
Bohrschen Radius anzutreffen ist. Die
Bezeichnung "kreisförmiges Atom" ist also stark
vereinfachend.
Bemerkenswert ist vor allem, dass sich die
"Aufenthaltsbereiche" mit benachbarten
Quantenzahlen fast vollständig überlappen. Wenn
also ein Elektron "nicht genau weiß", zu welcher
Bohrschen Bahn es gehört, kann es auch beide
nehmen: Schrödingers Elektron!
Diese Schrödinger-Elektronen leben in
Rydbergatomen sehr lange (Millisekunden) und man
kann sie mit Mikrowellen nicht nur von einer
"Bohrschen Bahn" zur anderen schieben, sondern
auch die Phase ihres Zustands verändern - und
messen! Mehr dazu später.
|

|
| Wir sollten uns also um die Phase dieser
Zustände (die man nun wieder als
"Superpositionszustände" neu entdeckt hat)
kümmern. Sie steht in der Exponentialfunktion:
|
|
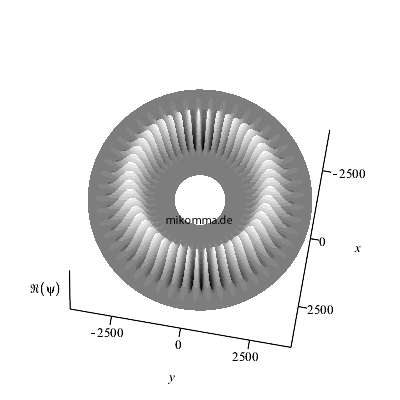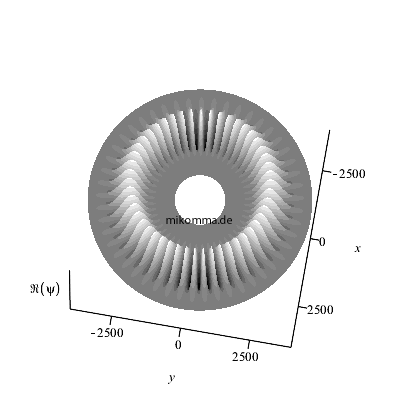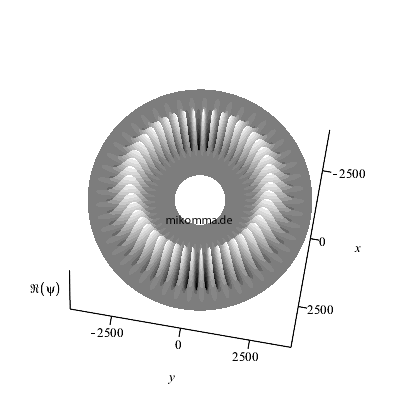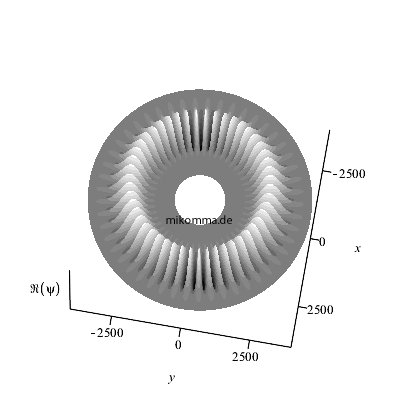
Hier ist der Realteil (nach oben über der
"x-y-Äquatorebene des Atoms" abgetragen) des
azimutalen Anteils dargestellt für n = 50, also
m = 49 (bitte nachzählen :-).

|
Wenn man noch den Zeitfaktor berücksichtigt,
bewegt sich der Realteil des "stationären
Zustands". Die Darstellung des Betragsquadrats
würde natürlich weder eine azimutale Struktur
noch ihre zeitliche Veränderung zeigen.
|
Was geschieht, wenn "man zwei benachbarte
Zustände überlagert" - rein rechnerisch, oder
wenn das Elektron nicht genau weiß, ob es zu
n = 50 oder n = 51 gehört?
|
|
| Die Quantenzahlen m unterscheiden
sich um 1. Azimutal gibt es also auf einer Seite
ein Minimum und auf der anderen ein Maximum des
"Superpositionszustandes":
Kreisförmige Schwebung, sowohl im Realteil...
|
als auch im Betragsquadrat. Das bedeutet
aber, dass das Elektron mit dem positiven Kern
(in der Mitte zu denken) einen elektrischen
Dipol bildet.
|

|

|
Bewegt sich etwas?
Ja - das Elektron! mit seinem Realteil (und
Imaginärteil)
|
und natürlich auch dem Betragsquadrat!
|

|

|
| Der elektrische Dipol rotiert also, und zwar
mit der Schwebungsfrequenz (für Rubidium etwa
51GHz) der beiden "stationären Zustände", oder
mit der
Gruppengeschwindigkeit.
|
Anders ausgedrückt: Durch die Überlagerung
der Zustände, oder beim Übergang von einem
"stationären Zustand" zum anderen, wird das Elektron zu einem
lokalisierbaren Wellenpaket (sonst könnte es ja
auch nicht strahlen :-).
|
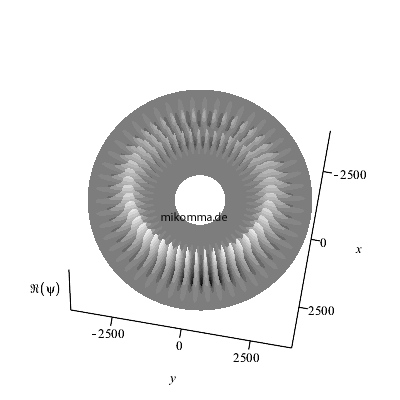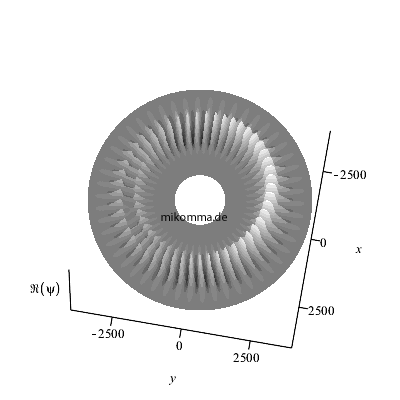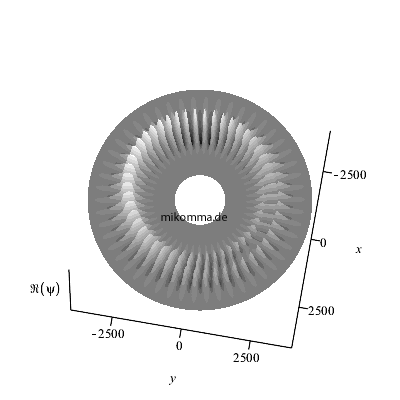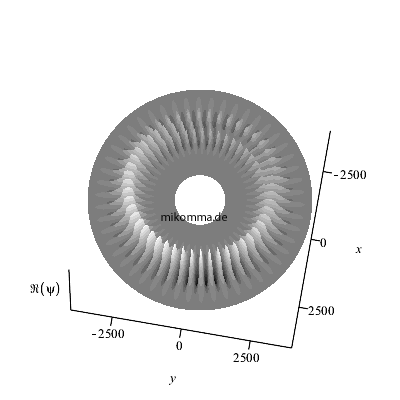
Hier ist noch eine andere Art der
Darstellung: Die Überlagerung wurde nur für
n = 48 bis n = 52 berechnet.
Außerhalb und innerhalb dieses Bereiches sind
die "stationären Zustände" zu sehen. Die
Animation läuft im Sekundentakt, damit man
besser verfolgen kann wie die "Zahnräder
ineinander greifen".
Natürlich ergeben sich durch die Wahl der
Zeitschritte (also der "Messung")
stroboskopische Effekte. Das Verhältnis der
mittleren Frequenz der beiden "stationären
Zustünde" und der Übergangsfrequenz (=
Schwebungsfrequenz) ist etwa n/2 und
nicht ganzzahlig.
|
|
|
|
|
Einmal mehr ist von einem Quantensprung weit und breit nichts
zu sehen. Rydbergatome haben eine sehr hohe Lebensdauer (> 10ms), weil die
abgestrahlte Leistung sehr klein ist. Die abgestrahlte Leistung ist einerseits
proportional zum Quadrat der Beschleunigung des Elektrons. Weil die
Schwebungsdauer proportional zu n3 ist und der mittlere
Bahnradius proportional zu n2, ist also die
Strahlungsleistung proportional zu n-8.
Andererseits ist die mittlere Strahlungsleistung gleich der abgestrahlten
Energie dividiert durch die Lebensdauer. Also ist die Lebensdauer proportional
zu n5.
Würde man das Atom sich selbst überlassen, so würde also das Elektron "in aller
Seelenruhe" und unter Missachtung aller verbotenen Zonen von energetisch
höheren zu niedrigeren Zuständen übergehen und dabei eine Spektrallinie nach der
anderen abstrahlen,
siehe auch. Aber es kommt noch besser:
Setzt man das Atom in einen gut verspiegelten Hohlraum, so
kann es die abgestrahlte Energie wieder absorbieren und oszilliert zwischen zwei
benachbarten Zuständen, wenn der Hohlraum gut abgestimmt ist: Rabioszillationen,
etwa um das Millionenfache langsamer als die Strahlungsfrequenz, also 51kHz im
genannten Beispiel.
Es kommt aber noch besser: Durch gezielte
Einstrahlung von Mikrowellenpulsen, kann man das Elektron nach Belieben hin- und
herschieben (energetisch, aber auch räumlich). Auf den unteren Zustand oder den
oberen oder eine Superposition. Wenn man das zweimal macht, hat man (mit
geeigneten Pulsen) ein Ramsey-Interferometer, bei dem die Pulse wie Strahlteiler
wirken. Verschiebt sich zwischen den "Strahlteilern" (Ramsey-Zonen) die Phase
des "präparierten Zustands", so ändert sich die Intensität an den Ausgängen des
Interferometers.
Am besten wäre es natürlich, wenn man jetzt noch einen
Phasenschieber hätte. Aber keine Sorge - auch das geht und man bekommt dafür
sogar den
Nobelpreis, denn mit diesem Phasenschieber kann man ein Photon nachweisen,
ohne es zu absorbieren!
Und wie geht das (mit dem Phasenschieber)? Wenn ein Atom durch
einen Hohlraum fliegt, der verspiegelt ist und auf die Übergangsfrequenz zweier
Niveaus richtig abgestimmt ist, so verschieben sich die Niveaus (light shift).
Ein Beispiel mit den Zahlen aus "Quantum jumps of light
recording the birth and death of a photon in a cavity", Sébastien Gleyzes, ...,
Serge Haroche,
doi:10.1038/nature05589 (Hochachse: Kreisfrequenz in Hz,
Zeitachse in Sekunden):
Wenn der Hohlraum wirklich leer ist
(elektromagnetisches Vakuum, Anzahl der Photonen
n = 0), wird nur das obere Niveau (rot)
angehoben. Das untere Niveau (blau, auf der
t-Achse) bleibt unverändert. Achtung: in diesen
Darstellungen ist der Abstand (51GHz) zwischen
den (unverschobenen) Niveaus nicht
berücksichtigt.

|
Wenn sich ein Photon im Hohlraum befindet, wird
zusätzlich das untere Niveau abgesenkt.

|
Will man unterscheiden, ob sich ein Photon im
Hohlraum befindet oder keines, so muss man die
Differenz der Verschiebungen bilden...

|
und daraus die resultierende Verstimmung.

|
Wenn man alles richtig
gemacht hat, sammelt das "Atom im
Superpositionszustand" - also der rotierende
Dipol - bei der Passage durch den Hohlraum
gerade die zusätzliche Phase π auf, die man im
Interferometer braucht, um oben genanntes
Experiment optimal durchzuführen.
Die nebenstehende Abbildung zeigt das
Zeitintegral der "Verstimmung", die dafür sorgt,
dass der Dipol währen der Passage durch die "Gaußmode"
etwas schneller rotiert.
|

|
Belichtet man den rotierenden Dipol mit der
passenden Frequenz, so sieht die
Phasenverschiebung so aus (Realteil der
Wellenfunktion):
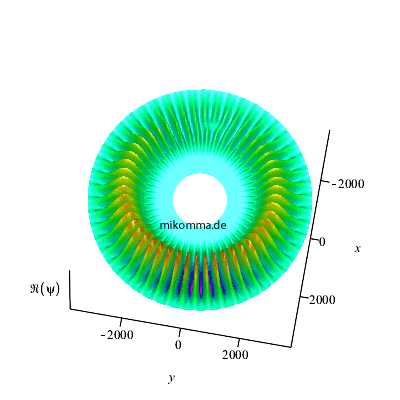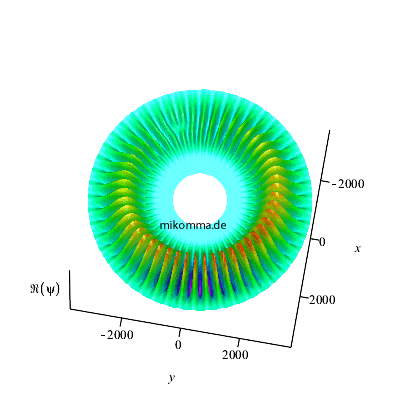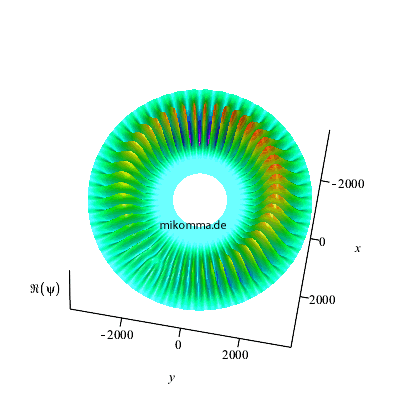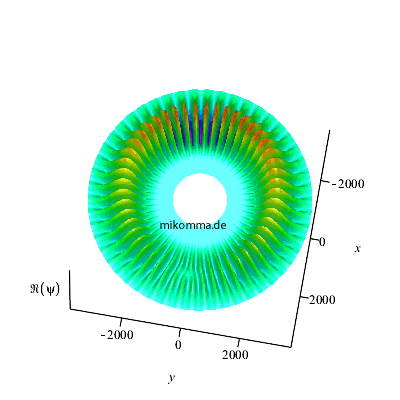
|
Betragsquadrat

|
| Nebenbei gesagt: Ein
Zwei-Niveau-System ist eine Realisierung eines
Qubits. Sie sehen hier also wie man die Phase
eines Qubits schiebt, das sich in einem
Überlagerungszustand befindet :-).
|
|
Nun werden Sie fragen: "Warum spricht dann S. Haroche in
seiner Nobel lecture davon, dass er Schrödingers Frage "
Are
there quantum jumps" positiv beantwortet hat? Fragen Sie mich etwas
Leichteres! Wenn es die von Schrödinger abgelehnten instantanen
Bohr/Einsteinschen Quantensprünge gäbe, könnte Haroche seine Experimente gar
nicht machen.
Und weshalb heißt der Artikel "Quantum jumps of light
recording the birth and death of a photon
in a cavity"? Weil man nur alle
Millisekunden nachschaut, ob das Photon noch im Hohlraum ist. Falls nicht, so
ist es aus dem (offenen!) Hohlraum ins Vakuum außerhalb des Hohlraums "gesprungen". Nun ja - wenn ich um
12 Uhr in der Sonne auf meinem Balkon einschlafe und um 15 Uhr wieder aufwache,
ist die Sonne auch weg-"gesprungen" und ich liege im Schatten. So ist das halt
mit stroboskopischen Aufnahmen...
|